home aquaristik exoten reisen schule sitemap volltextsuche gästebuch kontakt impressum
Nachstehender Text wurde als Vortrag 1999 zu verschiedenen Veranstaltungen der Lehrerweiterbildung in Berlin, Dresden, Leipzig und Herrenhuth gehalten und steht damit auf dem Stand des damaligen Wissens. Neuere Recherchen haben lediglich ergeben, dass sich insbesondere die im Vortrag zu ethischen Fragen der Problematik geäußerten Bedenken verschärft haben, der Fortschritt in der Therapie allerdings kaum nennenswert ist (Jan. 2001).
Wohl mögen Regen und Thau, und
unfruchtbare Jahre,
gemacht werden durch eine uns
unbekannte und
nicht unter unsrer Gewalt stehende
Macht;
aber die ganz eigenthümliche Zeit
der Menschen,
die menschlichen Verhältnisse,
machen nur die Menschen sich selber
und schlechthin keine ausser ihnen
befindliche Macht.
(J. G. Fichte)
Was die wahre Freiheit und den
wahren Gebrauch derselben
am deutlichsten
charakterisiert,
ist der Mißbrauch
derselben.
(G. Ch. Lichtenberg)
Erbkrankheiten und Erbberatung
Fallbeispiele und ihr didaktischer Einsatz im Unterricht der Sekundarstufe II
Gliederung:
Erbkrankheiten – Versuch einer Begriffsbestimmung
Darstellung der Thematik in der Schulbuch-Literatur
alternative Vorschläge zu den „gängigen Schulbeispielen"
Erbberatung
– klassische Stammbaumanalysen
– Genscreening und pränatale Diagnostik
Quelle: Wildenburg, Dorothea (1997): Gentechnik und Freiheit, Sic et non
Der Laie fühlt sich in der Diskussion um die (Human)genetik eigentümlich hilflos. Diese Hilflosigkeit resultiert zum Teil - wie häufig im Zusammenhang mit wenig einsichtigen Technologien - aus einem gewissen Grad von Uninformiertheit. Zur Angst gesteigert wird dieses Gefühl aber sicherlich auch durch die Meldungen der Presse in den letzten Wochen und diverse Horrorszenarien einschlägiger Science-Fiction-Filme. Diese Fiktionen scheinen mit einem Mal Wirklichkeit zu werden, und es ist nicht mehr möglich, sich mit der Befriedigung, einen spannenden Abend verbracht zu haben, in den Fernsehsessel zurücksinken zu lassen.
Wie einen Rettungsanker bemüht man auf dieser Ebene der meist sehr emotional geprägten Ablehnung oft das Argument der "Würde des Menschen", die durch das Vorgehen der Gentechnologie angetastet werde - ohne jedoch genauer zu artikulieren, worin diese Würde denn bestehe bzw. inwiefern sie bedroht werde. Auch der Entsetzensruf, daß hier unerlaubter Weise in die Schöpfung eingegriffen werde, liefert letztlich keinen Orientierungspunkt, mit dessen Hilfe vernünftig argumentiert werden kann, denn, ohne das Gefühl eines Gläubigen verletzen zu wollen, wieso darf nicht in die Schöpfung eingegriffen werden? Wird nicht bereits in die Schöpfung, wie immer man sie auch definieren will, eingegriffen, indem man Krankheiten zu heilen versucht? Eine andere Ablehnungsvariante findet sich auch in dem Argument, es gebe ein (nicht näher erläutertes und daher diffus bleibendes) "Recht auf Geheimnis" .
Ziel dieser Einleitung ist der Versuch, sich einer ethischen Beurteilung der (Human)genetik anzunähern. Angestrebt ist dabei, ein Kriterium zu finden, mit Hilfe dessen sich die Vorgehensweisen innerhalb der (Human)genetik (wie letztlich innerhalb jeder anderen Technologie auch) beurteilen lassen. Inwiefern dieses Kriterium, wenn es denn auf theoretischer Ebene gefunden wird, innerhalb der Gesellschaft auch umgesetzt werden kann, und welche Schwierigkeiten sich bei dieser Umsetzung ergeben, nur angedeutet werden.
Wie die eingangs erwähnten Horrorszenarien vielleicht deutlich machen, sind es die Folgen der (Human)genetik, die zu ängstigen vermögen. Das Dilemma einer solchen Folgendiskussion liegt jedoch darin, daß es ganz vom bereits gefaßten Standpunkt eines jeden abhängt, welcher Seite er sich anschließt. Immer wieder werden die Pessimisten mit den Optimisten darüber in Streit geraten, welche Visionen die realistischeren sind. Die Optimisten betonen die Aussichten auf eine positive Entwicklung zum Wohle der Menschheit, die Möglichkeit, Krankheiten zu verhindern, neue Medikamente zu entwickeln etc. Wer wollte sich dagegen aussprechen? Die Pessimisten sehen den künstlich herstellbaren Übermenschen auf sich zukommen, eine Welt voller identischer Wesen, die Mensch zu nennen dann kaum noch statthaft wäre, befürchten als Resultat dieser Entwicklung die Umstrukturierung des Menschen zur herstellbaren Funktion.
Um die Gentechnologie unter ethischen Gesichtspunkten diskutieren zu können, ist es unmöglich, sich dieser Folgendiskussion zu entziehen. Genforschung "an sich" (gedacht nun in sehr abstraktem Sinne) ist nicht verwerflicher als bspw. Mathematik, weder moralisch noch unmoralisch. Moralisch oder unmoralisch wird erst die Anwendung der erzielten Erkenntnisse.
Daraus ergibt sich die außerordentlich schwierige Situation, daß hier ein Forschungsprogramm diskutiert werden muß, was in seinen Auswirkungen noch in keiner Weise völlig abschätzbar ist. Es handelt sich immer nur um mögliche Folgen, also um solche, die wir als wahrscheinlich betrachten.
Doch auch diese Folgen, so wenig sie konkret vorhersehbar sind, können und müssen ebenfalls nach einem bestimmten Maßstab beurteilt werden. Folgen können aber nur insofern ethisch beurteilt werden, als sie im Rahmen einer allgemeinen Zwecksetzung betrachtet werden. Um es an einem Beispiel zu verdeutlichen: Nur mit der bereits vorhandenen Maxime, die Umwelt soll geschützt werden, ist es möglich, die Verschmutzung des Rheins durch Chemikalien zu verurteilen. Ohne diesen vorher festgesetzten Zweck ist es nicht möglich, eine Handlung bzw. deren Folgen zu beurteilen. Gesetzt also den Fall, es gebe eine Welt, in der die Umwelt keinerlei Rolle spielt, wird niemand auf den Gedanken kommen, ein solches Verhalten als negativ aufzufassen. Kurz: Ohne allgemeine Zwecksetzung keine Folgenbewertung.
Um Gentechnologie ethisch zu diskutieren, muß man deren Folgen in Erwägung ziehen. Diese Folgen werden ihrem Inhalte nach von verschiedenen Wissenschaftlern sehr kontrovers diskutiert. Um aber Folgen ethisch beurteilen zu können, bedarf es, wie bereits ausgeführt, eines darüberstehenden Rahmens der Zwecksetzung. Diese höchste Zwecksetzung, unter der letztlich alle Einzelaspekte betrachtet werden müssen, ist die Freiheit des Menschen unter Achtung des für alle gültigen (wenn auch nicht immer geltenden) Gesetzes. Ich beziehe mich hier explizit auf die „Allgemeine Menschenrechtsdeklaration" der UNO, Artikel 3: „Jeder Mensch hat das Recht auf Leben, Freiheit und Sicherheit der Person."
Diese Freiheit nun wird nicht nur dadurch verletzt, daß ein Vernunftwesen das andere ausnutzt, mißhandelt oder tötet (und damit als Mittel behandelt). Die konkrete Freiheit des Menschen wird auch beeinträchtigt, wenn er krank ist - und an diesem Punkt befinden wir uns wieder im Problemkreis der (Human)genetik.
Kaum jemand wird Anstoß daran nehmen, sein Blut untersuchen zu lassen, sich einer Gehirnoperation zu unterziehen oder zum Zahnarzt zu gehen. Dies dient in erster Linie dem unmittelbaren Zweck, Schmerzen oder andere Behinderungen zu beseitigen. Die Beseitigung des Schmerzes ermöglicht dann z.B. die ungehinderte Lektüre eines Buchs oder einen genußreichen Kinobesuch etc.etc. In diesen Fällen scheint die Entscheidung, ob eine solche medizinische Vorgehensweise gerechtfertigt ist oder nicht, leicht zu fällen. Die Mittel (Zahnbehandlung), um den Zweck (Schmerzfreiheit) zu erreichen, sind verantwortbar.
Was aber erregt die Gemüter, wenn sich die Medizin (bzw. Biologie) nicht der Mittel bisher anerkannter Verfahren bedient, sondern Gene manipulieren will?
Hypothetisch vorausgesetzt, daß die Gentechnologie dem höchsten Ziele des Menschen dienlich ist, nämlich insofern, als sie den Menschen dazu verhelfen könnte, gesund und damit verbunden frei zu sein (in oben dargestelltem Sinne), ist diese Technologie moralisch zu verantworten - und zwar ebenso zu verantworten wie eine Behandlung beim Zahnarzt. Die Frage, die sich stellt, ist eben diejenige, ob Gentechnologie tatsächlich das geeignete Mittel ist, den gesetzten Endzweck zu erreichen. Beispiel: Somatische Gentherapie. Bei diesem Verfahren werden nur die Erbanlagen in den Körperzellen verändert. Die genetischen Veränderungen aber werden nicht weitervererbt. Das Ziel einer solchen Behandlung ist es, genetisch bedingte Krankheiten entweder zu heilen oder aber ihren Ausbruch zu verhindern. Wenn Gentechnologie auf solche Weise eingesetzt wird, unterscheidet sie sich in keiner Weise von der schon erwähnten Zahnbehandlung - und ist moralisch vertretbar.
Sobald aber der letzte Zweck, die Freiheit des Individuums zu befördern, nicht handlungsleitend ist, muß die Anwendung der Genmanipulation abgelehnt werden. Die Gefahr eines Mißbrauchs besteht m.E. insbesondere bei der sogenannten Keimbahn-Therapie, bei der solche Zellen verändert werden, die vererbt werden. Konkret und provokativ: Bei dieser wäre es möglich zu bestimmen, wie ein Kind später aussehen soll, ob seine Nase lang oder kurz, seine Haare braun oder schwarz sein sollen.
Dieses Vorgehen muß deshalb abgelehnt werden, da hier der Mensch nicht mehr als Zweck, sondern nur noch als Mittel behandelt wird, er wird zum Objekt, zur Funktion. Dies ist auch dann der Fall, wenn sich Arbeitgeber ihre Arbeitnehmer danach aussuchen, ob sie streßresistent, krankheitsanfällig etc. sind - statt Überlegungen anzustellen, wie der Arbeitsplatz verbessert werden könnte. Und auch wenn sich Wissenschaftler dafür aussprechen, den Genpool des Menschen so zu verändern, daß er immun wird gegen den Muskelabbau unter Schwerelosigkeit und damit besser in der Raumfahrt eingesetzt werden könne. In diesen Beispielen wird der Mensch zur Funktion herabgesetzt, im Falle der Eltern wird das Kind zum Objekt eigener Wunschvorstellungen, im Falle des Arbeiters wie auch des Astronauten wird der Mensch zur effektiven Arbeitsmaschine.
Wenn man davon ausgeht, daß die Individualität des Menschen von der Zufälligkeit des Zusammentreffens männlicher und weiblicher Keimzellen abhängig ist, verbietet sich ein Eingriff in diese Zufälligkeit von selbst.
Ich werde bei der Diskussion der pränatalen Diagnostik auf diese Aussage noch einmal näher eingehen.
Das Kriterium zur Beurteilung des Einsatzes von Gentechnologie ist also die Freiheit des Menschen. Im emphatischen Sinne die Freiheit, die den Menschen erst zum Menschen macht, im konkreten Sinne die Freiheit, auf die jedes Individuum ein unveräußerliches Recht besitzt.
Erbkrankheiten – Versuch einer Begriffsbestimmung
Es scheint zunächst angebracht, sich mit dem Krankheitsbegriff an sich auseinanderzusetzen. Dazu möchte ich lediglich zwei lexikalische Werke zitieren.
Nach Meyers Lexikon ist eine Krankheit, eine Störung im Ablauf der normalen Lebensvorgänge in Organen und Organsystemen durch einen Reiz, der zu einer von der Norm abweichenden Beeinträchtigung der phys. und/oder psych. Befindlichkeit oder auch zu wahrnehmbaren körperlichen Veränderungen, im Extremfall zum Tod führt.
Nach „Encarta ‚98" ist eine Krankheit ein Zustand, in dem die normalen Vorgänge des menschlichen Organismus beeinträchtigt sind. Alle Krankheiten gehen mit einem Zusammenbruch der natürlichen Abwehrsysteme oder der Regelungsmechanismen des Körpers einher. Fast immer offenbart sich eine Krankheit durch eine Beeinträchtigung bestimmter physiologischer oder geistiger Prozesse.
Die Liste ließe sich beliebig fortsetzen, der Inhalt bliebe mehr oder weniger der selbe. Alle Definitionen beziehen sich auf eine nicht genauer erklärte Normalität der Lebensvorgänge – und eben an diesem Punkt erscheinen mir tiefergehende Betrachtungen erforderlich.
Im Verlauf der stammesgeschichtlichen Entwicklung des Menschen haben sich bestimmte Merkmale und Funktionen als Ausdruck des Gleichgewichts mit der Umwelt herausgebildet. Als typisch oder normal werden häufig diejenigen Merkmale und Funktionen bezeichnet, die der Mehrzahl der Individuen gemeinsam sind, als atypisch oder anormal werden die bezeichnet, die nur bei wenigen Individuen vorkommen. Die Größe des Bereichs „normal" wird von den Statistikern mit x ± 2s angegeben, das sind etwa 96% der sich um den Mittelwert (x) verteilenden Individuen.
Atypisch oder anormal heißt jedoch nicht unbedingt auch krank. Im Gegenteil, ein atypisches Merkmal kann sogar Gesundheit bedeuten. Ich komme wieder auf die Notwendigkeit von Zahnbehandlungen zurück. Die meisten Menschen haben kariöse Zähne, Karies ist damit typisch oder normal. Das heißt aber nicht, daß diese Individuen gesund und die wenigen ohne Karies krank sind.
Der Begriff der Norm kann also nicht zur Einteilung in krank und gesund herangezogen werden. Als krank müßte man also – ganz allgemein – ein Individuum bezeichnen, das auf Grund seines physischen und / oder psychischen Zustandes dauernd oder zeitweilig nicht in der Lage ist, unter den gegebenen Umweltbedingungen die für seine Existenz und Entwicklung wesentlichen und notwendigen Funktionen zu erfüllen. „Krank" ist also ein relativer Begriff. In zwei verschiedenen Umwelten kann das gleiche Merkmal vor- oder nachteilig sein. Ich verweise an dieser Stelle auf den selektiven Vorteil heterozygoter Hämoglobin – S Träger in malariaverseuchten Gebieten.
Eine bestimmte Änderung des Erbmaterials, eine bestimmte Mutation, kann also in einer Umwelt für das Individuum nachteilig, in einer anderen hingegen vorteilhaft sein. Aus der Erbänderung allein ist damit noch nicht zu rechnen, ob sie Ursache einer Krankheit sein wird oder nicht. Das wird erst in der Auseinandersetzung mit der Umwelt sichtbar. Ich möchte diese Aussage mit einem weiteren Beispiel belegen. 1996 entdeckte man eine Genveränderung, die für Silikose anfällig macht. Ein deutscher Küstenfischer oder alpenländischer Bergbauer hat auf Grund seiner Lebensumstände eine gegen Null gehende Wahrscheinlichkeit diese Disposition de facto zu erleben, bei einem Tischler oder Steinbrucharbeiter liegt sie hingegen bei fast 100%.
Hinsichtlich der Krankheitsdefinition muß ein weiterer Aspekt berücksichtigt werden – die gesellschaftliche Reflexion über das, was als krank oder gesund betrachtet wird.
Ein Schlaglicht auf den schleichenden Bewußtseinswandel in unserer Gesellschaft wirft eine Studie, die 1997 von der medizin-soziologischen Abteilung der Universität Münster durchgeführt wurde. Die Forscher gaben vor, ein Gen gefunden zu haben, an dem sich die Veranlagung zu starkem Übergewicht schon beim Ungeborenen nachweisen ließe. Dazu wurden 1200 Frauen befragt, sowohl Schwangere, die vorgeburtliche Tests gemacht hatten, als auch werdende Mütter vor den Tests und Frauen, die kein Kind erwarteten. Ein Drittel der Befragten meinte, ein Schwangerschaftsabbruch müßte erlaubt sein, wenn der Gentest diese Veranlagung zeigte. Jede fünfte Frau gab an, sie würde in einem solchen Fall abtreiben. Individuelle Normvarianten also, die vorgeburtlich diagnostiziert werden können, werden zunehmend als unzumutbare Behinderungen gewertet!
Ich möchte mit diesen letzten Bemerkungen auf das Problem der terminologischen Zuordnung von Erbgängen durch Schüler aufmerksam machen. Immer wieder werden in diesem Zusammenhang von Schülern die Begriffe Erbkranker oder Kranker verwendet. Meines Erachtens wäre es sinnvoll sich ausschließlich auf den Gebrauch des Begriffes Merkmalsträger festzulegen, um eine wie auch immer geartete Fehlbewertung zu vermeiden.
Darstellung der Thematik in der Schulliteratur
In der fachwissenschaftlichen Literatur sind ca. 6000 „Krankheiten" (ich verweise bei der Verwendung des Begriffes auf meine vorherigen Ausführungen) beschrieben, die sich auf Veränderungen des Erbmaterials zurückführen lassen. Je nach Autor variieren die nachfolgenden Angaben sehr stark. Von den 6000 folgen 1000 bis 1900 autosomal-rezessiven Erbgängen, etwa 1000 sind autosomal-dominant und ca. 150 haben sich als X-chromosomal herausgestellt. Für die verbleibenden knapp 3000 fehlt eine entsprechende Zuordnung in der Literatur.
Ich habe sieben verschiedene Lehrbücher und Kursmaterialien für die SII auf die verwendeten Beispiele in der Behandlung der Thematik hin untersucht. Dazu gehörten die Titel „Biologie" aus dem Schrödel- und Metzler-Verlag und die Kursmaterialien „Genetik" von Schrödel, bsv und Diesterweg.
Die von mir analysierten Lehrbücher beschränken sich bei der Behandlung des Themas weitgehend auf 6 Beispiele. Das sind die PKU, die Rot-Grün-Blindheit, die Bluterkrankheit, das Marfan-Syndrom, die cystische Fibrose/Mucoviscidose und numerische Chromosomenaberrationen. Eine Ausnahme machen die jüngst erschienenen Lehrbücher und Materialien von bsv und Schrödel, in denen weitere Beispiele , wie Chorea Huntington, die familiäre Hypercholesterinämie und die Galactosämie neben den klassischen Beispielen aufgeführt werden. Nun wäre es vermessen, von den Schulbuchverlagen den neuesten wissenschaftlichen Stand auf einem Forschungsgebiet zu erwarten, aber ein wenig mehr Innovation bei Nachauflagen dürfte m.E. schon vorausgesetzt werden.
Ist schon die Auswahl der verwendeten Beispiele relativ gering, sind Aussagen, die Anlaß zu einer ethisch-moralischen Diskussion Anlaß bieten eine ausgesprochene Rarität. Die Sensibilität der Gesellschaft für diese Thematik findet man nur in den Neuerscheinungen der letzten zwei Jahre. Wie ich bereits ausgeführt habe, ändert sich gerade die ethisch-moralische Bewertung des Einsatzes moderner Verfahren in der Gesellschaft mitunter sehr schnell, was einem Lehrbuch, das häufig länger als zehn Jahre genutzt werden muß, sicherlich abträglich wäre. Das war auch einer der Anlässe für die Ausarbeitung dieses Vortrages.
Ich möchte daher im folgenden einige ausgewählte Beispiele erörtern, die sich als Alternative zu den „klassischen" Erbkrankheiten anbieten. Es geht dabei nicht darum, die Bedeutung oder den Wert der üblichen Schulbeispiele in Frage zu stellen, sondern um eine Erweiterung der Arbeitsmöglichkeiten für den Lehrer. So können die vorgestellten Alternativen im Unterricht zur Erarbeitung der Erbgänge eingesetzt werden und die im Lehrbuch dargestellten zur Festigung, bzw. Übung.
Aus der Fülle der Literaturangaben wurden Beispiele gewählt, die es ermöglichen, den Bezug zu bereits erarbeiteten Themenkomplexen herzustellen und damit themenübergreifend zu behandeln, oder als Vorabinformation für noch zu besprechende Inhalte einzusetzen. In erster Linie können dabei Verbindungen zur Physiologie und zum Zellstoffwechsel herausgearbeitet werden. Der Umfang, der einzelnen Erörterungen wurde dabei in erster Linie durch die Menge der verfügbaren Literaturquellen bestimmt und in zweiter durch persönliche Wichtung.
Übersicht:
|
Erbgang |
Schulbeispiel |
Alternative |
|
autosomal - rezessiv |
PKU |
Albinismus totalis |
|
autosomal - dominant |
Marfan-Syndrom |
Chorea Huntington |
|
X-chromosomal rezessiv |
Rot/Grün-Blindheit Bluter-Krankheit |
G6PD-Mangel (Glucose-6-phospat-dehydro-genase-Mangel) |
|
X-chromosomal dominant |
k.A |
Zahnschmelzmangel |
|
polygen |
Marfan-Syndrom |
Schizophrenie |
|
heterogen |
k.A. |
Albinismus totalis angeborene Taubstummheit |
Albinismus totalis:
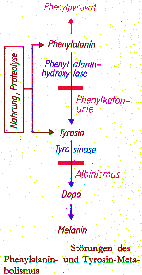
Albinismus totalis, also der völlige Ausfall der Pigmentbildung, beruht auf einer Störung des Tyrosinstoffwechsels. Das Fehlen der Tyrosinase verhindert die Umsetzung des Tyrosins zum Dihydroxyphenylalanin, das als Melanin-Präkursor für die Farbstoffbildung erforderlich ist. Die Folge ist ein vollständiger Mangel an Melanin in allen Körperzellen. In diesem Zusammenhang bietet ein Hinweis auf den Tyrosinstoffwechsel, nämlich der erbliche Mangel an Phenylhydroxylase die Möglichkeit, das Interesse auf die PKU zu lenken und damit eine Motivation für weitere Bearbeitungen autosomal-rezessiver Erbgänge zu schaffen. In diesem Zusammenhang können auch festigende Übungen zum Zellstoffwechsel durchgeführt werden.

Chorea Huntington:
1872 beschrieb der englische Arzt Huntington ein Nervenleiden, das über mehrere Generationen die Angehörigen einer Familie betroffen hatte. Im Volksmund wurden die Erscheinungsbilder dieser Krankheit auch als „Veitstanz" benannt.
Der fortschreitende Krankheitsverlauf führt zu einem völligen Verlust der Kontrolle der Bewegungsabläufe und der geistigen Fähigkeiten. Allerdings ist die Schwere der Erkrankung individuell unterschiedlich, das heißt, die Expressivität des Gens ist variabel, wobei die Penetranz 100% beträgt. Der Träger des Gens dieser Krankheit wird also in jedem Fall derselben erliegen, ungewiß ist lediglich die Schwere der Symptomatik.
Die Historie von Chorea Huntington bietet nicht nur Möglichkeiten einen geschichtlichen Bezug, bspw. zu damit verbundenen Hexenprozessen im Mittelalter zu finden, sondern auch die gesellschaftliche Reflexion im Zusammenhang mit der Entwicklung der Medizin zu betrachten.
Darüber hinaus ist die Möglichkeit gegeben die Begriffe Expressivität und Penetranz einzuführen oder zu festigen.
Da die Krankheit heute gen-diagnostisch erkannt werden kann, aber nicht heilbar ist, ergibt sich z.B. die Möglichkeit einer ethischen Diskussion über die Frage, ob ein positives Ergebnis dem Betroffenen mitgeteilt werden soll oder nicht. Ich werde auf diese Frage später noch einmal eingehen.
G6PD-Mangel (Glucose-6-phosphat-dehydrogenase-Mangel):
G6PD-Mangel ist die häufigste genetisch kontrollierte Enzymabnormität. Nach Schätzungen sind weltweit etwa 100 Millionen Männer betroffen.
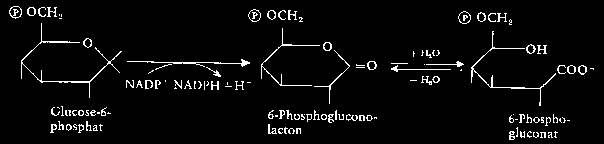
Infolge von Aminosäuresubstitution entstanden ca. 80 G6PD-Varianten , von denen 20 eine chronische hämolytische Anämie verursachen. Die Betroffenen zeigen eine rasche körperliche Ermüdbarkeit, Beklemmung, Atemnot und Herzklopfen, da der Organismus durch beschleunigte Blutzirkulation den Mangel an Sauerstoff zu kompensieren versucht.
40 der G6PD-Varianten weisen normale oder nur geringfügig reduzierte G6PD-Aktivität auf und sind ohne klinische Folgen.
Die verbleibenden Varianten zeigen unter normalen Bedingungen keine Symptome, verursachen dann aber hämolytische Anämie, wenn die betroffenen Personen Saubohnen genießen, oder mit bestimmten Drogen behandelt werden, z.B. mit bestimmten Analgetika, Sulfonamiden, Antimalariamitteln, Chloramphenikol und anderen.
Der G6PD-Mangel bietet sich also nicht nur als Beispiel für x-chromosomal rezessive Erbgänge an, sondern auch die Möglichkeit die Bedeutung der Umwelt für den Ausbruch von Erbkrankheiten zu diskutieren. Darüber hinaus können Hinweise auf die Zusammenhänge zwischen erblicher Krebsdisposition und Umweltfaktoren gegeben werden
Zahnschmelzmangel:
Ich habe den erblich bedingten Zahnschmelzmangel als Beispiel für einen X-chromosomal dominant vererbten Defekt ausgewählt, da an diesem Beispiel die eingangs besprochene Krankheitsdefinition den Schülern nicht nur deutlich gemacht werden kann, sondern auch diskutiert, daß Symptome ein und derselben Erkrankung auf unterschiedliche Ursachen zurückzuführen sind. Karies können also erblich bedingt sein oder auf mangelnder Mundhygiene beruhen.
Es muß allerdings eingefügt werden, daß Karies nicht die einzigen Konsequenzen des erblichen Zahnschmelzmangels sind. Durch das Fehlen ist auch die mechanische Abnutzung der Zähne in weitaus höherem Maße gegeben und auch die Abläufe der Demineralisierung des Dentins sind stark beschleunigt.
Schizophrenie:
Schizophrenie gehört in den westlichen Kulturen zu den schwerwiegendsten psychischen Erkrankungen, unter anderem deshalb, weil ihre typischen Symptome, so z.B. das Stimmenhören, innerhalb dieser Kulturen als sehr absonderlich und beunruhigend angesehen werden. In anderen Kulturen jedoch können diese Symptome als Zeichen für eine besondere Begabung angesehen werden. So zeigt sich beispielsweise eine große Ähnlichkeit zwischen den Halluzinationen Schizophrener und der Trance von Schamanen, die in ihrer Kultur als besonders weise und auserwählte Menschen verehrt werden.
Häufigkeit
In der Bundesrepublik Deutschland und den westeuropäischen Ländern leiden zwischen 0,5 bis 1% der Bevölkerung an Schizophrenie (Prävalenz). Die jährliche Neuerkrankungsrate (Inzidenz) liegt bei etwa 0,05%. Die Wahrscheinlichkeit eines Menschen, im Laufe des Lebens an Schizophrenie zu erkranken (Morbiditätsrisiko), wird auf ca. 1% geschätzt, dabei sind Frauen und Männer gleich häufig betroffen. Männer erkranken meist früher als Frauen. Insgesamt liegt das Haupterkrankungsalter zwischen der Pubertät und dem 30. Lebensjahr, wobei es für die verschiedenen Subtypen der Schizophrenie charakteristische Unterschiede im Zeitpunkt der Ersterkrankung gibt.
Grundlagen und Ursachen
Bei der Verursachung von Schizophrenie wird von einem Zusammenwirken unterschiedlicher Faktoren ausgegangen, wobei angenommen wird, daß die genetische Veranlagung (Disposition) eine zentrale Rolle spielt.
Untersuchungen im verwandtschaftlichen Umfeld von an Schizophrenie erkrankten Personen haben Belege für eine genetische Veranlagung ergeben. So zeigt sich, daß die Wahrscheinlichkeit, ebenfalls an Schizophrenie zu erkranken, mit steigendem Verwandtschaftsgrad zum Erkrankten zunimmt. Sind beide Elternteile erkrankt, liegt das Risiko, ebenfalls an Schizophrenie zu erkranken, bei dem Kind bei ca. 40 %. Bei zweieiigen Zwillingen liegt die Wahrscheinlichkeit, daß der Zwilling eines Schizophrenen ebenfalls erkrankt ist bei ca. 15 %, bei eineiigen Zwillingen bei 50% (Konkordanzrate).
Diese hohe, aber nicht hundertprozentige Übereinstimmung zeigt, daß die genetische Grundlage nicht als alleinige Ursache angesehen werden kann. Sie wird vielmehr als Disposition verstanden, die nur zur Erkrankung führt, wenn andere Faktoren hinzukommen. Als Beispiele für solche Faktoren, die bei einer genetischen Veranlagung zum Ausbruch von Schizophrenie führen, gelten Schädigungen im Mutterleib und besonders krisenhafte Lebensereignisse.
Da die Schizophrenie polygen verursacht wird, gibt es eine Fülle unterschiedlicher Symptome mit unterschiedlich starker Ausprägung, von denen hier nur einige genannt werden können.
Es gibt keine Symptome die nur bei Schizophrenie auftreten. Alle Symptome können für sich allein genommen auch bei vielen anderen Erkrankungen auftreten, es können aber folgende charakteristische Symptombereiche genannt werden:
- Wahn:
Beim Wahn handelt es sich um eine nichtkorrigierbare falsche Beurteilung der Realität. Häufige Wahnvorstellungen bei Schizophrenen sind Verfolgungs- und Beziehungsideen, dabei wird das Verhalten anderer vom Patienten wahnhaft auf sich selbst bezogen. Der Wahn kann sich sowohl ohne, als auch mit Bezugnahme auf äußere Wahrnehmungen äußern.
- Halluzinationen:
Hierunter versteht man eine Sinneswahrnehmung, die für einen wirklichen Sinneseindruck gehalten wird, obwohl der entsprechende reale Sinnesreiz nicht vorhanden ist. Diese Sinnestäuschung kann alle Sinnesorgane betreffen, wobei akustische Halluzinationen am typischsten für Schizophrenie sind. Am häufigsten hören Schizophrene Befehle erteilende und sich über ihn unterhaltende fremde Stimmen.
- Ich-Störungen:
Dieses Symptom ist dadurch charakterisiert, daß die Grenzen zwischen Ich und Umwelt als durchlässig empfunden werden. Dabei werden häufig die eigene Person (Körper, Gefühle, Gedanken) oder die Umwelt als fremdartig erlebt. Es kann zu einem Gefühl der Fremdbeeinflussung oder Gedankeneingebung von außen kommen, auch kann der Patient das Gefühl haben, daß seine Gedanken mitgehört oder ihm entzogen werden. Dabei lebt der Kranke zugleich in einer wirklichen und in einer wahnhaften Welt, wobei es immer mehr zu einer Abkapselung von der realen Welt kommt.
- Formale Denkstörungen:
Hierbei handelt es sich um eine Verzerrung des Denkablaufs. Es kommt zur Verschmelzung verwandter Wörter zu einem Begriff, zu teilweise absurden Wortneuschöpfungen, Zerfahrenheit mit sprunghaften und unlogischen Gedankengängen oder zum plötzlichen Abbruch eines Gedankenganges ohne erkennbaren Grund.
- Affektive Störungen:
Typischerweise ist bei Schizophrenen der emotionale Kontakt zu anderen Menschen reduziert. Es kann zu Situationen nicht angemessenen Gefühlsäußerungen oder mimischen Reaktionen kommen. Häufig ist bei Patienten eine leere also grundlose Heiterkeit zu beobachten. Unvereinbare Gefühlszustände und Wünsche können nebeneinander stehen. Insbesondere beim Bestehenbleiben einer Restsymptomatik nach Abklingen der akuten Erkrankung kommt es zu erheblicher gefühlsmäßiger Verarmung.
Der Einsatz des Beispiels bietet einmal die Möglichkeit, die Kenntnisse über Polygenie, die ja meist am Beispiel der Hautfarben erläutert wird zu festigen. Es ist aber darüber hinaus möglich, an diesem Beispiel die Bedeutung der sozialen Umwelt auf den Krankheitsverlauf der Betroffenen zu diskutieren. In diesem Zusammenhang bietet es sich auch an, philosophische Aspekte der individuellen Reflexion der Wirklichkeit zu berücksichtigen.
angeborene Taubstummheit:
Heterogene Erbgänge sind in besonderem Maße geeignet, den Schülern abweichende Mendel-Spaltungen zu verdeutlichen und bereits erworbene Kenntnisse zu festigen und mit neuen Inhalten zu verbinden.
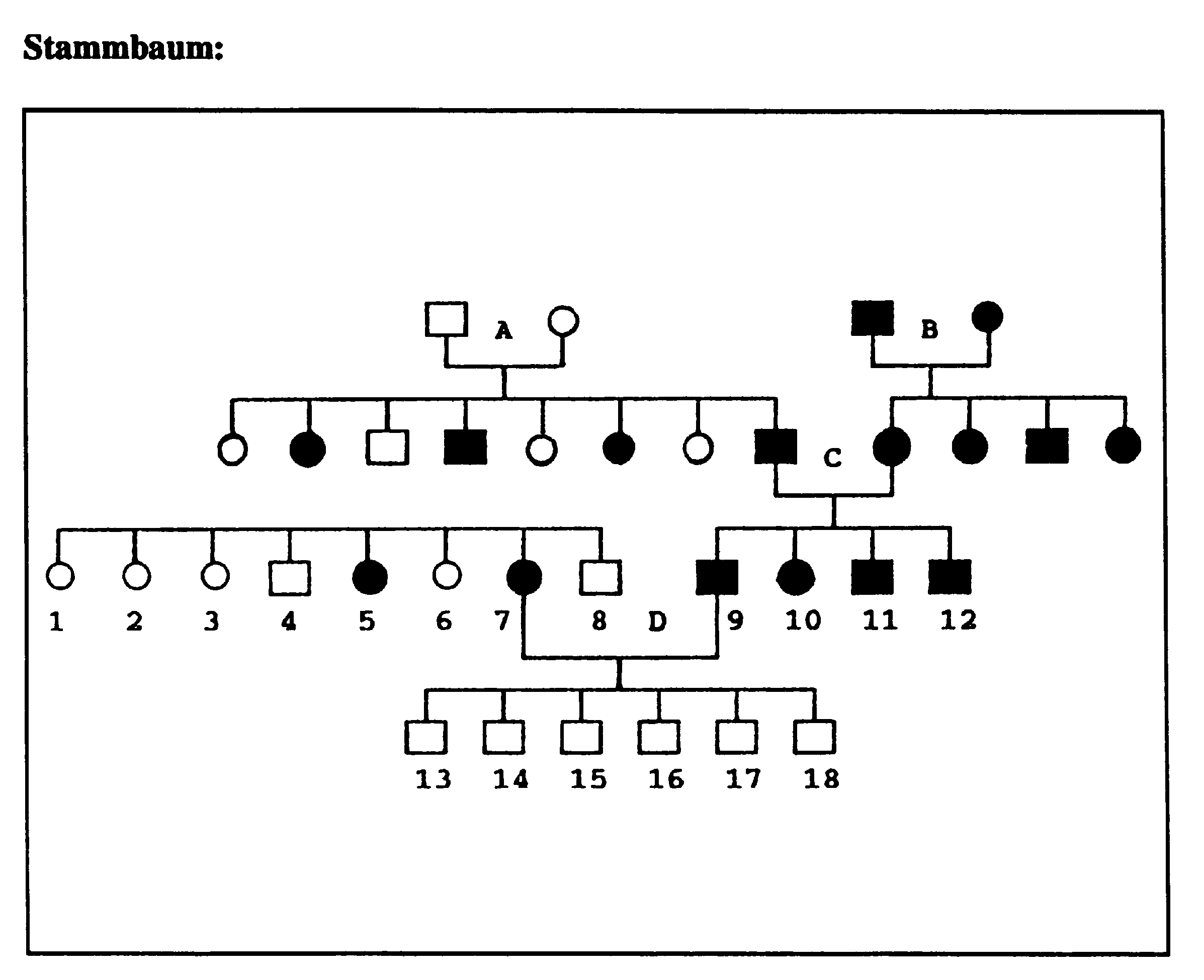
Vorstehender Stammbaum gibt die Vererbung der Taubstummheit vor. Das Merkmal kann durch zwei verschiedene Gene unabhängig voneinander ausgeprägt werden.
Es bietet sich bei der Behandlung von Beispielen zur Heterogenie auch an, auf die Möglichkeit einer kryptomeren, also verdeckten Polygenie hinzuweisen.
Stammbaumanalysen:
Spätestens seit der Verurteilung eines Frankfurter Arztes zu lebenslangen Unterhaltszahlungen an ein Kind, dessen Erbkrankheitsrisiko er geleugnet und damit die Eltern des Mädchens vor dessen Geburt falsch beraten hat, wird die Bedeutung der Stammbaumanalyse deutlich. Dieses Urteil macht es möglich, eine entsprechende Motivation zu erzeugen.
Als Aufgabenstellung bietet sich die Analyse verschiedener Stammbäume an.
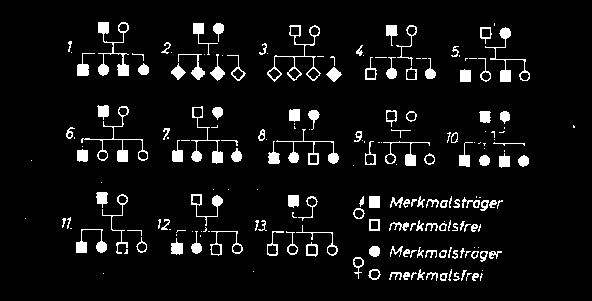
Aufgabe 1: Ermitteln Sie die zu den Stammbäumen gehörigen Erbgänge und begründen Sie Ihre Auffassung. (Die Nachkommen entsprechen sowohl vom Geschlecht, als auch der Anzahl der Merkmalsträger den statistischen Erwartungen)
Bei der Lösung der Aufgabe sind die Schüler gezwungen, so die entsprechenden Fähigkeiten nicht vorhanden sind, mit Hilfe Punnett’scher Kreuzungsquadrate die Lösung zu finden und gegen andere Möglichkeiten abzugrenzen oder diese einzubeziehen.
Die zweite Aufgabe dient der Festigung der Berechnung verschiedener Erwartungswahrscheinlichkeiten für das auftreten bestimmter Allelkombinationen.
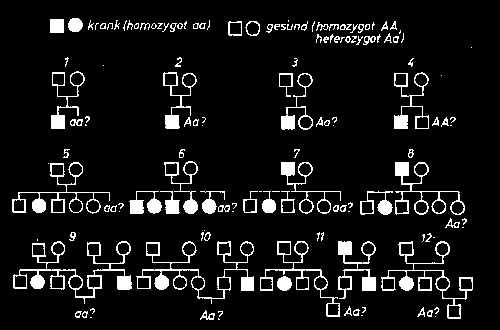
Ermitteln Sie die Wahrscheinlichkeiten, mit denen die im Stammbaum hinterfragten Allelkombinationen auftreten können.
Genscreening und pränatale Diagnostik
Prof. Ulrich Langenbeck, Leiter des Instituts für Humangenetik des Universitätsklinikums Frankfurt/Main äußerte sich 1996 gegenüber dpa: Genormte Gene gibt es nicht. ,,Jeder hat drei bis vier Defekte Im Erbgut". Bereits jetzt lassen sich laut Langenbeck rund 500 der etwa 6000 bekannten genetisch bedingten Krankheiten nachweisen, für etwa 100 gibt es direkte Tests der DNS (Desoxyribonukleinsäure).
Für fast alle im Erbgut angelegten Krankheiten gilt allerdings: Test ja - Heilung nein. Gerade einmal an weltweit 600 Patienten werden derzeit Gentherapien erprobt, bislang ohne durchschlagenden Erfolg.
In Deutschland bieten derzeit 28 Universitätskliniken und etwa 60 niedergelassene Ärzte Gentests an, und der Bedarf steigt. Nach Prof. Holger Höhn (Würzburg) werden am Universitätsklinikum jährlich 100 Beratungen und Tests mehr durchgeführt. Die meisten Menschen, die sich anmelden, haben Erbkrankheiten in der Familie und wünschen sich Kinder.
Die sogenannte präsymptomatisch medizinisch-genetische Diagnostik kann genetisch bedingte Risiken erkennen, die unter Umständen im Leben der betroffenen Person gar nicht zum Tragen kommen.
Anläßlich der 1996 stattgefundenen Fachtagung der Schweizerischen Ärztegesellschaft FMH zum Thema «Genomanalyse und die Schweizer Ärzteschaft» rief Prof. Hansjakob Müller, Leiter der Abteilung Medizinische Genetik des Kinderspitals Basel denn auch die anwesenden FMH-Mitglieder zu einem besonnenen Umgang mit den gentechnologischen Instrumenten auf; er wies insbesondere auf die Problematik der genetischen Massenuntersuchung von ganzen Bevölkerungsgruppen hin: «Die Zustimmung der betroffenen Personen ist eine Grundvoraussetzung für die Durchführung einer genetischen Untersuchung. Genetische Tests sollten nur vorgenommen werden, wenn aufgrund des Resultats sinnvolle medizinische Maßnahmen getroffen werden können.» Zudem sollten solche Tests nur durchgeführt werden, fordert Müller, wenn eine kompetente Interpretation sowie eine einfühlsame Mitteilung der Resultate gewährleistet sei.
Mit dem wachsenden Wissen um Erbkrankheiten und Veranlagungen verschiebt sich das Verhältnis zwischen «Krankheit» und «Gesundheit»: Künftig kann bereits ein genetisch bedingtes Erkrankungsrisiko für die betroffene Person schwerwiegende Folgen haben: Jemand mit einer prognostizierten späteren Krankheit wird sowohl auf dem Arbeitsmarkt wie auch beim Abschluß einer Kranken- oder Lebensversicherung Probleme haben.
Dadurch, daß mögliche Krankheiten immer früher festgestellt werden könnten, stünden der Arzt, die Ärztin plötzlich im Zentrum der sozialen Fragen rund um die Versicherbarkeit von Arbeitnehmern und Selbständigerwerbenden, stellt Hanspeter Kuhn, stellvertretender Generalsekretar der FMH, fest. Probleme sieht er vor allem bei der Taggeldversicherung von Arbeitnehmern und Selbständigerwerbenden, da das Krankenversicherungsgesetz «Krankheiten, die bei der Aufnahme bestehen, durch Vorbehalt von der Versicherung ausschließen» kann.
Was dabei als Krankheit verstanden wird, bleibt offen. Doch befürchtet Kuhn, daß die zu erwartenden Fortschritte der medizinischen Diagnostik zur sozialen Ausgrenzung von arbeitsfähigen Menschen führen könnte. Laut Entscheid des Eidgenössischen Versicherungsgerichts gilt zum Beispiel die bloße HIV-Infektion bereits als «Krankheit» - ein Versicherungsvorbehalt ist also zulässig.
Analog zu diesem Beispiel muß auch bei Erbkrankheiten damit gerechnet werden, daß das Versicherungsgericht Vorbehalte zulassen würde, da eine mögliche spätere Erkrankungsursache ja ebenfalls bereits im Körper angelegt sei. Da Arbeitgeber und Krankenversicherung zum Teil sehr eng zusammenarbeiten, bestehe die Gefahr, so Kuhn, daß Leute mit genetisch bedingten gesundheitlichen Risiken auf dem Arbeitsmarkt zunehmend diskriminiert würden. Anpassungen im Arbeits- und Versicherungsgesetz könnten dieser Entwicklung vorbeugen.
Vorstehende Aussagen sind weitgehend Äußerungen namhafter Ärzte, die ich bewußt nicht kommentiert habe, weil sie für sich allein sprechen.
Die Bedenken beziehen sich in erster Linie auf die Konsequenzen, die das Human-Genom-Project mit sich bringen kann, nicht zwangsläufig aber hinsichtlich der Möglichkeiten der Anwendung der Erkenntnisse. Und damit schließt sich der Kreis der Betrachtungen.
Das Kriterium zur Beurteilung des Einsatzes von Gentechnologie ist die Freiheit des Menschen. Im emphatischen Sinne die Freiheit, die den Menschen erst zum Menschen macht, im konkreten Sinne die Freiheit, auf die jedes Individuum ein unveräußerliches Recht besitzt.
Die Zusammenstellung der Daten und Fakten beziehen sich auf Publikationen von Prof. Peter Meier-Abt und Prof. Karin Möller, beide ordentliche Proffessoren am Universitätsspital der Universität Zürich.
Gentherapie bedeutet allgemein die Einschleusung eines oder mehrerer Fremdgene in den Organismus mit therapeutischem Nutzen für das Individuum. In diesem Sinne kann auch jede Organtransplantation als eine spezielle Form von Gentherapie betrachtet werden, da durch den Organtransfer die Gene unzähliger somatischer Fremdzellen vom Spender auf den Empfänger übertragen werden. Somatische Zellen sind alle Körperzellen, die nicht an der Reproduktion eines Individuums beteiligt sind (zum Beispiel Muskelzellen, Blutzellen, Hirnzellen, Leber- und Nierenzellen). Entsprechend beschränken sich die Auswirkungen aller Modalitäten der somatischen Gentherapie auf das behandelte Individuum und werden nicht auf die Nachkommen übertragen. Eine definitive Eliminierung einer Erbkrankheit für alle Generationen würde gentherapeutische Eingriffe in die Keimbahn voraussetzen. Die Anwendung der Keimbahntherapie beim Menschen steht zur Zeit aber nicht zur Diskussion. Sie ist technisch noch nicht möglich, ethisch , wie bereits erwähnt problematisch und gesetzlich in vielen Ländern, so auch in Deutschland (Embryonenschutzgesetz) und der Schweiz (Artikel 24novies der Bundesverfassung), verboten. Die gegenwärtigen Diskussionen um die Möglichkeiten und Methoden der Gentherapie betreffen daher ausschließlich die verschiedenen Spielformen der somatischen Gentherapie.
Da viele Krankheitszustände durch die Synthese abnormer Proteine bedingt sind, stellt die Korrektur der abnormen Genexpression durch Gentherapie letztlich ihre einzige definitive Therapieform dar. Die erfolgreiche Anwendung der Gentherapie setzt die genaue Kenntnis von Genen und Gendefekten und deren Einfluss auf normale und pathologische Zellfunktionen voraus. Durch die Fortschritte der molekularen Genetik und die Entwicklung der rekombinanten Gentechnologie während der letzten 20 Jahre ist es heute möglich geworden, die bestimmten Krankheiten zugrundeliegenden Gendefekte rasch zu identifizieren (zum Beispiel mittels «positional cloning»). Gene können durch molekulare Scheren (Restriktionsenzyme) isoliert, mittels Ligasen in virale Vektoren (zum Beispiel Plasmide) eingebaut und in geeigneten Zellen (zum Beispiel Bakterien, Hefezellen) amplifiziert und exprimiert werden.
Methoden des Gentransfers
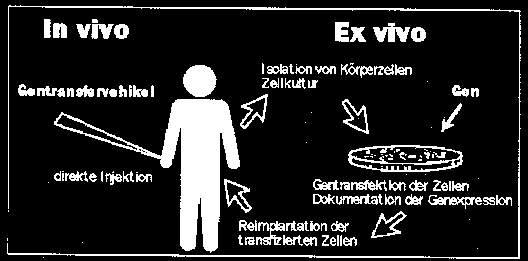
Eine wichtige Voraussetzung für eine erfolgreiche Gentherapie ist die effiziente und reproduzierbare Einschleusung und Expression eines gewünschten Gens in geeigneten Zellen. Bis heute wurde der Gentransfer in den meisten Fällen ex vivo durchgeführt (siehe Abbildung).
Hierbei werden die Zielzellen (zum Beispiel Lymphozyten, hämatopoetische Stammzellen, Leberzellen) aus dem Organismus isoliert, in Zellkultur mit dem gewünschten Gen transfiziert und schliesslich wieder in den Organismus reimplantiert. Durch ex vivo Gentransfer kann ein möglicher Gentransfer in Keimbahnzellen sicher ausgeschlossen werden. Ebenso sind in vitro Gentransfermethoden generell effizienter als die bis heute zur Verfügung stehenden in vivo Gentransfermethoden. Die Anwendbarkeit der ex vivo Gentherapie ist aber beschränkt auf jene Zellen, die relativ leicht aus dem Körper isoliert und in genügenden Mengen gezüchtet werden können. Zudem gelingt die Reimplantation der in vitro transfizierten Zellen in den Körper oft nur unvollständig und/oder die Expression des Transgens geht in vivo relativ rasch wieder verloren. Zur Aufrechterhaltung einer Langzeitsekretion eines Genproduktes in vivo wird auch versucht, genetisch modifizierte (transfizierte) Zellen in selektiv permeable Kapseln zu verpacken, die die Zellen vor einer Destruktion durch das Immunsystem schützen. In naher Zukunft ist der weitere Fortschritt der somatischen Gentherapie vor allem abhängig von der Entwicklung von sicheren und leicht anwendbaren in vivo Gentransfermethoden, welche eine effiziente und stabile Genexpression in bestimmten Zielorganen erlauben. Grundsätzlich gibt es virale und nicht-virale Gentransferverfahren. Virale Transfermethoden benutzen spezielle genetisch modifizierte Viren («virale Vektoren») als Transportvehikel für genetisches Material. Obwohl eine Vielzahl von Viren auf ihren potentiellen Nutzen in der Gentherapie hin untersucht worden sind, werden am häufigsten replikationsdefiziente Retro- und Adenoviren verwendet. Retrovirale Vektoren haben den Vorteil, dass sie das gewünschte Gen in das Genom von sich teilenden Zielzellen integrieren (wenn auch nur «random») und damit zu einer stabilen Genexpression in Mutter und Tochterzellen führen können. Im Gegensatz dazu können mit adenoviralen Vektoren auch nicht proliferierende Zielzellen effizient transfiziert werden. Das gewünschte Gen wird aber nicht in das Genom integriert, und die Genexpression ist lediglich transient und wird durch eine antivirale Immunantwort zusätzlich limitiert. Transiente Genexpression kann auch mit einer Reihe von nicht-viralen Transfermethoden erreicht werden wie zum Beispiel durch direkte Injektion von DNA in das Gewebe (zum Beispiel Muskulatur, Schilddrüse), mit Liposomen oder mittels rezeptor-vermitteltem Gentransfer. Die letztere Methode ermöglicht einen zielgerichteten in vivo Gentransfer in spezielle Zellen und Organe. So kann zum Beispiel DNA durch Komplexierung mit Asialoglykoprotein (ASGP) via den leberzellspezifischen ASGP-Rezeptor spezifisch in Leberzellen eingeschleust werden. Eine andere Möglichkeit zur gewebsspezifischen Genexpression ist die Verwendung von gewebsspezifischen Promotoren (= Genabschnitte, die die Transkription kontrollieren). So wird beispielsweise Alpha-Foetoprotein (AlphaFP) beinahe ausschliesslich durch Leberzellkarzinome gebildet. Durch Kopplung mit dem AlphaFP-Promotor kann erreicht werden, dass ein gewünschtes Gen ausschliesslich in hepatozellulären Karzinomzellen exprimiert wird.
Anwendungen der somatischen Gentherapie
Anwendungsmöglichkeiten der Gentherapie ergeben sich vor allem auf drei Gebieten, nämlich den klassischen Erbkrankheiten mit isoliertem Einzelgendefekt, den erworbenen genetischen Erkrankungen (zum Beispiel chronische Infektionskrankheiten) und den multifaktoriellen genetischen Erkrankungen (zum Beispiel Tumoren, Herz- und Kreislaufkrankheiten).
Die Liste neuentdeckter Gendefekte wächst rasch und bietet breite Möglichkeiten für die Gentherapie. Das eigentliche Therapieziel ist dabei der Genersatz für das defekte oder fehlende Gen, das heisst, das Defektgen müsste selektiv aus dem Genom herausgeschnitten und das normale Gen an exakt der gleichen Stelle eingesetzt werden können. Nur ein solchermassen durch homologe Rekombination rekonstruiertes Gen würde der normalen Genregulation unterliegen. Leider ist effizienter Genersatz durch homologe Rekombination bis heute nicht möglich. Die gegenwärtig verfügbaren Gentransfermethoden erlauben lediglich eine Genaddition mit transienter oder im Falle der retroviralen Vektoren «randomly integrated» Genexpression. Die erste kausale Therapie durch Substitution eines fehlenden oder defekten Gens wurde bei der Adenosindeaminasemangelkrankheit durchgeführt. Bei dieser Krankheit liegt ein genetischer Defekt der Adenosindeaminase (ADA) vor. Der ADA-Mangel führt zu einer Akkumulation von Deoxyadenosin, das unter anderem eine direkte toxische Schädigung von T-Lymphozyten verursacht. In der Folge kommt es zu einer lebensbedrohlichen Immunschwäche. Bei vier Patienten konnte durch wiederholte retrovirale ex vivo Gentransfers in körpereigenen T-Lymphozyten ein deutlicher und über länger als ein Jahr persistierender Anstieg der ADA, eine markante Verbesserung der Immunreaktionen und ein Rückgang von klinisch manifesten Infektionen erzielt werden (Science 270, 470 und 475, 1995). Weniger eindrücklich waren die Resultate bei der familiären Hypercholesterinämie. Diese Krankheit führt infolge eines vererbten Rezeptordefektes (LDL-Rezeptor) in der Leber zu stark erhöhten Cholesterinwerten im Blut und zu frühzeitiger Arteriosklerose bereits im Kindesalter. Durch adenoviralen ex vivo Gentransfer in isolierten Leberzellen und Reimplantation der mit dem normalen LDL-Rezeptorgen transfizierten Hepatozyten in die Patientenlebern konnte lediglich in drei von fünf Patienten eine partielle Reduktion der Serumcholesterinwerte über mindestens vier Monate erreicht werden (Nature Med. 1, 1148,1995).
Diese Resultate zeigen deutlich die Grenzen der ex vivo Lebergentherapie und unterstreichen die Notwendigkeit von effizienteren in vivo Gentransfermethoden.
Neben der Gentherapie klassischer Erbkrankheiten werden erhebliche Anstrengungen zur Krebs- und AIDS-Therapie unternommen, auf die in diesem Rahmen leider nicht eingegangen werden kann.
Zusammenfassend muß festgestellt werden, daß die Möglichkeiten der Gentherapie bisher zu keinen bahnbrechenden Erfolgen geführt haben. Das Bild, daß in der Presse gezeichnet wird ist also mehr das eines Zerrspiegels, was die Notwendigkeit einer ethischen Diskussion der Problematik trotzdem nicht überflüssig macht.
home aquaristik exoten reisen schule sitemap volltextsuche gästebuch kontakt impressum